药物临床试验机构信息公示
日期:2025年02月28日 来源:网站编辑 浏览:1324次
临床试验机构办事指南
机构办联系方式0871-65610072
办公地址
1、临床试验机构办公室(以下简称机构办)地址: 云南省精神病医院5号楼 1 楼临床试验机构办公室
2、机构GCP中心药房地址: 云南省精神病医院5号楼 1 楼临床试验机构GCP中心药房
3、机构资料室地址: 云南省精神病医院5号楼 1 楼临床试验机构资料室
初次沟通与 SSU(临床试验启动前的准备阶段) 流程
1、申办方/CRO(合同研究组织) 应首先联系机构办主任沟通承接意向:如先与合作 PI(主要研究者) 联系,应尽快与机构办主任联系。
2、申办方/CRO 发送项目简介(方案摘要等)至邮箱:ynsjsbyygcp@163.com。
3、机构办主任根据方案及适应症等初步评估是否有承接能力,必要时汇报机构主任评估。
4、双方互有合作意向后,可组织安排双方或多方沟通和接洽,沟通和接洽方式包括电话、邮件和现场交流。
5、沟通和接洽内容包括:了解申办方/CRO 项目合作需求、完成申办方/CRO 项目调研问卷、介绍研究中心工作流程和对接人、提供研究中心实施基础条件、可
推荐项目承接科室和 PI。
6、沟通结果反馈:申办方/CRO 向研究中心反馈调研结果,双方确定合作意向后,申办方/CRO 根据研究中心立项要求开始准备立项资料。
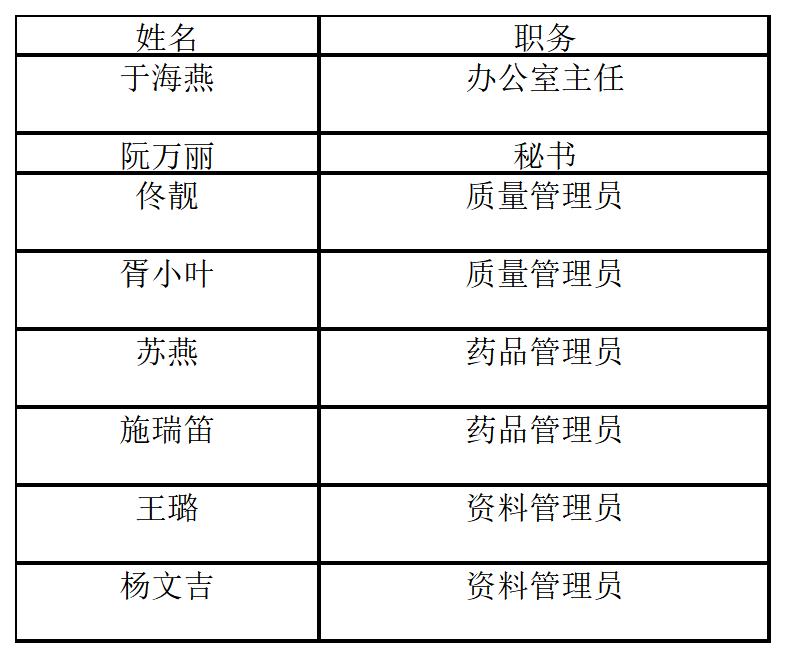
联系人:阮万丽
立项流程
1、立项流程
1. 确立合作意向
申办者/CRO与机构办公室或专业科室负责人联系临床试验项目后,机构办公室主任与专业科室负责人共同评估是否同意承接该项临床试验并告知申办者/CRO。
2. 提出立项申请
(1) 合作意向确立后,机构办公室主任与专业科室负责人确定主要研究者。
(2) 机构办公室主任、主要研究者参加多中心研究者会议,针对临床试验方案、知情同意书等进行讨论。
(3) 主要研究者提出立项申请,并连同相关资料发送给机构办秘书,同时提交已签名的纸质版《临床试验立项申请表》。
(4) 机构办公室秘书登记临床试验相关信息,包括申办者/CRO、项目名称、监查员姓名及联系方式、专业科室、主要研究者、方案接收时间、方案讨论会日期等。
(5) 立项清单如下:
|
序号 |
文件名 |
应提供份数 |
备注 |
|
1 |
临床试验立项申请提交文件清单 |
1 |
/ |
|
2 |
临床试验立项申请表 |
1 |
原件 |
|
3 |
药物临床试验批件/备案文件(含临床试验默示许可公示截图) |
1 |
加盖申办者/CRO章 |
|
4 |
临床试验方案(注明版本号及日期,含方案认可签署页) |
1 |
加盖申办者/CRO章 |
|
5 |
研究者手册(注明版本号及日期) |
1 |
加盖申办者/CRO章 |
|
6 |
知情同意书(注明版本号及日期) |
1 |
加盖申办者/CRO章 |
|
7 |
招募受试者的相关材料(包括广告,如有请提供) |
1 |
加盖申办者/CRO章 |
|
8 |
保险证明 |
1 |
加盖申办者/CRO章 |
|
9 |
病例报告表 |
1 |
加盖申办者/CRO章 |
|
10 |
受试者日记、受试者信息卡(如有请提供) |
1 |
加盖申办者/CRO章 |
|
11 |
申办者及CRO的资质证明(营业执照、GMP证书) |
1 |
加盖申办者/CRO章 |
|
12 |
项目委托相关文件(申办者对CRO委托函、申办者/CRO对CRA委托函及被委托人培训证书) |
1 |
加盖申办者/CRO/SMO章 |
|
14 |
试验用药品检验合格报告(包括试验药、对照药等) |
1 |
复印件需加盖申办者/CRO章 |
|
15 |
产品说明书(已上市药物需要) |
1 |
/ |
|
16 |
组长单位及其他中心伦理审查意见 |
1 |
复印件需加盖申办者/CRO章 |
|
17 |
主要研究者及研究者简历及资格证书(执业资格证、职称证、GCP证书) |
1 |
/ |
|
18 |
其它(如有请自行增加) |
1 |
加盖申办者/CRO章 |
3. 审核、批准立项申请
3.1 机构办公室秘书及其他人员核对申请表中相关内容,并对提交材料进行形式审查和科学性审查。
3.2 机构办公室主任审核“临床试验立项申请表”及试验相关材料后,综合专业科室意见,根据科室资质、条件、设施、人员情况、主要研究者临床试验项目在研情况等,审批申请项目在本中心专业科室进行临床试验,签名并注明日期。
3.3 机构办公室秘书及时将立项审查结果通知申办方或CRO代表
(1) 不同意立项,可将申办方和CRO资料退回,申办方/CRO声明无需退回的,则由机构办负责销毁,退回或销毁需做好相应记录。
(2) 需要补充材料或有问题需要协商或澄清,机构办秘书及时通知申办方补充材料重新递交,跟进至问题解决后立项。
3.4 伦理审查申请
临床试验立项申请经审核批准后,主要研究者向伦理审查委员会提交伦理审查申请。
3.5 伦理审查
本中心伦理审查委员会对临床试验项目进行伦理审查, 并形成书面审查记录和伦理审查批件。
3.6 签订协议
(1) 与申办者/CRO签订临床试验协议,明确双方权利、义务及责任分担等,项目经费应纳入财务部门统一管理。
(2) 建立临床试验经费管理制度,对批准立项的临床试验经费进行统一管理。经费的收取、使用和分配应当遵循财务管理制度,专业科室和个人不得私自收受临床试验项目经费及相关设备。



